Das Glucosetransporter Typ-1 Defizienz-Syndrom (GLUT1DS) ist eine sehr seltene, auto-somal-dominant vererbte, neurometabolische Erkrankung, die 1991 zum ersten mal von De Vivo et. al. im New England Journal of Medicine anhand von 2 Fallberichten als epilepti-sche Enzephalopathie beschrieben wurde. Bei beiden Patienten begannen im Alter von etwa 3 Monaten zerebrale Anfälle, die nicht auf Antikonvulsiva ansprachen. Erstes Indiz für einen Glukosetransporterdefekt war eine ungeklärte Hypoglykorrhachie, bei der das Verhältnis der Glukosekonzentration im Liquor cerebrospinalis zur Blutglukosekonzentration 0,19-0,35 statt des Normalwerts von 0,65 betrug. Die Behandlung mit einer KD führte bei beiden Pati-enten zu einer nahezu normalen neurologischen Entwicklung und Beendigung der Anfälle. (Vivo, D C de et al., 1991)
Verantwortlich für das GLUT1DS sind Mutationen im SLC2A1-Gen, das für den GLUT-1-Transporter codiert. Dieser ist beim Menschen auf der Membran der Erythrozyten und der Gehirnkapillarendothelzellen (Blut-Hirn-Schranke) exprimiert und katalysiert unter anderem den insulinunabhängigen Transport von Glukose. Die häufigsten Mutationen des SCL2A1-Gens sind Punktmutationen, gefolgt von Deletionen, frameshift- und Misssense-Mutationen. Die Tatsache, dass Patienten mit denselben Mutationen nicht immer dieselben Symptome haben, deutet auf zusätzliche Mechanismen wie Histon- oder posttranslationale Modifikationen hin, die möglicherweise zur Pathophysiologie der Erkrankung beitragen. (Nickels K und Wirrell E, 2010; Veggiotti P und Giorgis V de, 2014)
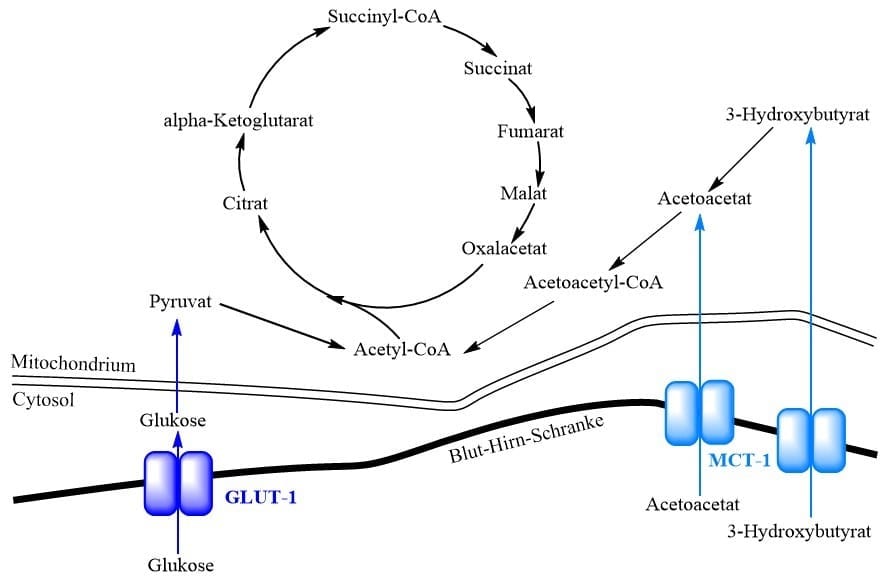
Der durch unausreichenden Glukosetransport in das Gehirn entstehende zerebrale Energiemangel kann durch eine KD teilweise aufgehoben werden, da Ketonkörper unabhängig von GLUT-1 über MCTs aufgenommen werden (s. Abbildung). Da so der Glukosestoffwechsel um-gangen werden kann, sind KDs die Therapie der Wahl. Während die KD bei Epilepsie im Ju-gendalter meist diskontinuiert wird, ist sie bei GLUT1DS eine lebenslange Behandlungs-form. (Klepper J, 2012)
Vivo DC de, Trifiletti RR, Jacobson RI, Ronen GM, Behmand RA, Harik SI. 1991. Defective Glucose Transport Across the Blood-Brain Barrier as a Cause of Persistent Hypoglycorrha-chia Seizures and Developmental delay. N Engl J Med, 325(10): 703–709.
Nickels K, Wirrell E. 2010. GLUT1-ous Maximus Epilepticus the Expanding Phenotype of GLUT-1 Mutations and Epilepsy. Neurology, 75(5): 390–391.
Veggiotti P, Giorgis V de. 2014. Dietary Treatments and New Therapeutic Perspective in GLUT1 Deficiency Syndrome. Curr Treat Options Neurol, 16(5): 291.
Klepper J. 2012. GLUT1 Deficiency Syndrome in Clinical Practice. Epilepsy Res, 100(3): 272–277.
Lass uns mal Klartext reden. Braucht unser Gehirn jetzt Kohlenhydrate? Oder nicht?
Wenn du 3-6 Mal am Tag kohlenhydratreiche Mahlzeiten und Snacks zu dir nimmst, dann verbrennen die Nervenzellen deines Gehirns Kohlenhydrate um Energie zu gewinnen. Genauer gesagt nutzen sie einen ganz bestimmten Vertreter der Kohlenhydrate: die Glukose. Weil das Gehirn ausreichend Glukose zur Verfügung hat, sieht es gar nicht ein, sich mal die anderen Möglichkeiten anzusehen. Denn… „Was der Bauer nicht kennt, frisst er nicht“.
Wenn du aber deinen Fettstoffwechsel trainierst, wenn du einmal ganz konsequent auf Kohlenhydrate verzichtest, dann ist das Gehirn gezwungen sich nach einer Alternative umzusehen und alte Gewohnheiten zu durchbrechen. Wir hängen doch auch immer wieder an unserem inneren Schweinehund fest. Bis wir einmal wirklich gezwungen sind etwas zu ändern. Dann merken wir oft, dass das gar nicht so schwer ist.
Auch für das Gehirn ist die Umstellung eigentlich gar nicht so schwer: Bereits nach 3 Tagen ohne Kohlenhydratzufuhr ist die Verbrennung von Ketonkörpern im Gehirn, die sogenannte Ketolyse, erhöht. Die Ketonkörper decken dann etwa 25% des Energiebedarfs des Gehirns. Nach 5-6 Wochen decken sie bereits die Hälfte. Diese Untersuchungen wurden meist an Menschen durchgeführt, die komplett gefastet haben. Wenn man einer ketogenen Diät folgt, passiert die Umstellung ein klein wenig langsamer. Insgesamt kann man sagen: Je höher die Konzentration von Ketonkörpern im Blut ist, desto mehr Ketonkörper zieht das Gehirn zur Energiegewinnung heran.
Nicht jedes Molekül, nicht jeder Stoff kann einfach mal so einen Abstecher ins Gehirn machen. Das Gehirn ist ein sehr exklusiver Club. Die Blut-Hirn-Schranke sorgt dafür, dass nur geladenen Gästen Eintritt gewährt wird. Ok, ein paar fremde Eindringlinge gibt’s immer. Fettlösliche Substanzen wie Alkohol oder Nikotin können sich – leider – einfach zwischen den Zellen hindurch quetschen. Ketonkörper hingegen quetschen sich nicht heimlich durch, sie kommen über den roten Teppich direkt durch den Haupteingang. Denn die Blut-Hirn-Schranke besitzt spezielle Transporter, die Ketonkörper gezielt aufnehmen: Den Monocarboxylat-Transporter MCT (hat nichts mit MCT-Öl zu tun). Dieser MCT kann mit etwa der selben Effektivität Ketonkörper aufnehmen, wie der Glukosetransporter GLUT-1 Glukose aufnehmen kann.
Vielleicht hast du schon einmal davon gehört, dass unser Körper MCT-Öl (von middle chain triglycerides = mittelkettige Fettsäuren) besser zu Ketonkörpern umwandeln kann als anderes Fett. Das stimmt tatsächlich, und durch MCT-Öl können sogar in Anwesenheit von Kohlenhydraten Ketonkörper entstehen. Zudem gibt es mittlerweile sogar die Möglichkeit Ketonkörper direkt aufzunehmen. Jetzt könnte man meinen „super“, hau ich mir halt jeden Morgen einen Kaffee mit MCT-Öl rein und esse dazu meine Käsesemmel. Wozu noch auf Kohlenhydrate verzichten? So einfach ist das nicht. Denn das Gehirn muss langsam daran gewöhnt werden Ketonkörper aufzunehmen. Die Aufnahmekapazität steigt erst mit der Zeit.
Das Gehirn braucht Zucker. Solang es nie daran gewöhnt wurde, Ketonkörper zu nutzen. Sobald das Gehirn regelmäßig Ketonkörper geliefert bekommt, nimmt es sie dankbar an und verwendet immer mehr Ketonkörper zur Energiegewinnung. Es wird unabhängig von Zucker. Äußerst praktisch, denn Ketonkörper entstehen aus Fett und das haben wir immer mit dabei. Es gibt also kein Nachmittagstief mehr – das Gehirn ist rund um die Uhr optimal versorgt. Ich halte eine ketogene Diät nicht für die optimale Dauer-Lösung für alle. Aber es lohnt sich, diesen Weg einmal zu erkunden.
Unter normalen Bedingungen mit regelmäßiger Nahrungszufuhr oxidieren die Neuronen des Gehirns nahezu ausschließlich Glukose zur ATP-Produktion, und Ketonkörper leisten nur einen sehr geringen Beitrag zur Energieversorgung. Erst in einer ketogenen Stoffwechsellage werden Ketonkörper vermehrt als Energieträger herangezogen. Bereits nach 3-tägigem Fasten ist die Ketolyse im Gehirn erhöht, sodass Ketonkörper etwa 25 % des zerebralen Energiebedarfs decken (Hasselbalch SG et al., 1994).
In einer Studie aus dem Jahr 1967 zeigte die Katheterisierung von Blutgefäßen des Gehirns adipöser Patienten, bei der man die arteriovenöse Differenz der Metaboliten maß, dass 3HB und AcAc nach 5- bis 6-wöchigem Fasten für mehr als die Hälfte des zerebralen Sauerstoffverbrauchs verantwortlich waren (Owen OE et al., 1967). Heutzutage verbieten sich solch invasive Humanstudien zumeist aus ethischen Gründen. Deswegen werden für neuere Erkenntnisse zum zerebralen Metabolismus der Ketonkörper hauptsächlich Studien an Nagetieren durchgeführt und vereinzelt Humanstudien mit Positionen-Emissions-Tomographie (PET) und radioaktiv markiertem AcAc oder 3HB als Tracer. Häufiger werden Untersuchungen bei Nahrungskarenz durchgeführt als bei ketogener Diät.
Eine PET-Studie an fünf gesunden Männern, bei der nach Injektion von
R-beta-[1-11C]Hydroxybutyrat der zeitliche Verlauf des Tracers im Gehirn untersucht wurde, fand eine starke Korrelation zwischen der Utilisation von 3HB im Gehirn und der Plasmakonzentration des Ketonkörpers (Blomqvist G et al., 1995). Der Transport der Ketonkörper über die Blut-Hirn-Schranke scheint der geschwindigkeitsbestimmende Schritt zu sein (Blomqvist G et al., 2002). Diese Erkenntnisse passen zu Feststellungen an Versuchen mit Mäusen (Pifferi F et al., 2011).
Während die Ketonkörper in andere Gewebe über die Diffusion durch Zellmembranen gelangen, wird ihr Transport über die Blut-Hirn-Schranke von Monocarboxylat-Transportern (MCT) vermittelt, welche außerdem Pyruvat, Laktat und α-Ketosäuren transportieren (Bouteldja N et al., 2014). Es existieren 2 Subtypen des MCT im Gehirn. MCT-1 in den Endothelzellen der Blut-Hirn-Schranke und MCT-2 in den Neuronen und Glia-Zellen. Der kM-Wert des MCT ist ähnlich dem kM-Wert von GLUT-1, der die Glukoseaufnahme in das Gehirn katalysiert.
Die Tatsache, dass die Ketonkörperkonzentration im Gehirn trotz vergleichbarer Blutkonzentration bei Fasten höher ist als bei akuter Ketonkörperinfusion, zeigt, dass Ketonkörper zwar immer in das Gehirn aufgenommen werden können, die Aufnahmekapazität aber induzierbar ist und ihr volles Ausmaß erst nach einer Adaptionsperiode durch langanhaltendes Fasten oder langfristige Ketogene Diät erreicht (Bouteldja N et al., 2014). Eine Besonderheit des zerebralen Ketonkörpermetabolismus ist, dass möglicherweise bestimmte Zellen im Gehirn – Astrozyten – zur Ketogenese fähig sind (Auestad N et al., 1991; Guzmán M und Blázquez C, 2001).
Auestad N, Korsak RA, Morrow JW, Edmond J. 1991. Fatty Acid Oxidation and Ketogenesis by Astrocytes in Primary Culture. J Neurochem, 56(4): 1376–1386.
Blomqvist G, Alvarsson M, Grill V, Heijne G von, Ingvar M, Thorell JO, Stone-Elander S, Widén L, Ekberg K. 2002. Effect of acute hyperketonemia on the cerebral uptake of ketone bodies in nondiabetic subjects and IDDM patients. Am J Physiol Endocrinol Metab, 283(1): E20-E28.
Blomqvist G, Thorell JO, Ingvar M, Grill V, Widén L, Stone-Elander S. 1995. Use of R-Beta-1-11C-Hydroxybutyrate in PET Studies of Regional Cerebral Uptake of Ketone Bodies in Humans. Am J Physiol, 269(5): E948-E959.
Bouteldja N, Andersen LT, Møller N, Gormsen LC. 2014. Using Positron Emission Tomography to Study Human Ketone Body Metabolism a Review. Metabolism, 63(11): 1375–1384.
Guzmán M, Blázquez C. 2001. Is there an Astrocyte-Neuron Ketone Body Shuttle. Trends Endocrinol Metabol, 12(4): 169–173.
Hasselbalch SG, Knudsen GM, Jakobsen J, Hageman LP, Holm S, Paulson OB. 1994. Brain metabolism during short-term starvation in humans. J Cereb Blood Flow Metab, 14(1): 125–131.
Owen OE, Morgan AP, Kemp HG, Sullivan JM, Herrera MG, Cahill GF. 1967. Brain Metabolism during Fasting. J Clin Invest, 46(10): 1589–1595.
Pifferi F, Tremblay S, Croteau E, Fortier M, Tremblay-Mercier J, Lecomte R, Cunnane SC. 2011. Mild Experimental Ketosis Increases Brain Uptake of 11C-Acetoacetate and 18F-Fluorodeoxyglucose a Dual-Tracer PET Imaging Study in Rats. Nutr Neurosci, 14(2): 51–58.
Hilfe! Ohne Kohlenhydrate werden wir alle sterben!! Das Gehirn braucht Zucker, Zucker, Zucker. Sonst heißt es Alaaaarm in den grauen Zellen!!! Der Stoffwechsel geht kaputt!
Nene, jetzt mal halblang. Keine Panik auf der Titanic. Unsere Spezies hätte nicht über hundert tausende von Jahren hinweg überlebt, wenn unser Körper so empfindlich wäre. In vielen Gebieten der Erde gab es wenig bis gar keine Kohlenhydrate. Außerdem gab es immer wieder längere Zeiten, in denen unsere Vorfahren ganz ohne Nahrung auskommen mussten.
Was im Stoffwechsel passiert, wenn er keine Kohlenhydrate erhält, ist ähnlich wie beim Fasten. Bei „Nahrungskarenz“ wie der Ernährungswissenschaftler sagt, passiert folgendes:
Nach einer gemischten Mahlzeit aus Kohlenhydraten, Proteinen und Fetten befindet sich der Stoffwechsel in der sogenannten „absorptiven Phase“, der Magen-Darm-Trakt verdaut und resorbiert die Nährstoffe der Mahlzeit. Die aufgenommenen Bestandteile des Essens werden entweder in den Körper eingebaut, gespeichert oder zu Energie verbrannt. Diese Phase ist „anabol“, das bedeutet nichts anderes als „körpereigene Strukturen aufbauend“. Je nachdem wie groß die Mahlzeit war und welche Zusammensetzung sie hatte, hält die absorptive Phase um die 3 Stunden an. Durch die Mahlzeit wurde Insulin ausgeschüttet weshalb das Verhältnis von Insulin zu seinem Gegenspieler Glukagon hoch ist. Man spricht von einer hohen Insulin/Glukagon-Ratio. Dieses Verhältnis fördert anabole Prozesse. Dazu gehört der Einbau von Aminosäuren in die Muskulatur, aber auch die Synthese von Glykogen zur Speicherung von Glukose in der Leber oder die sogenannte Lipogenese, die Speicherung von Fett als Energiequelle „für schlechte Zeiten“.
Wenn alle Nährstoffe vollständig resorbiert wurden, tritt der Stoffwechsel in die sogenannte postabsorptive Phase ein, die Phase „nach (post) der Absorption“. Dann sinken allmählich der Blutglukosespiegel und der Insulinspiegel. Der Glukagonspiegel hingegen steigt und somit sinkt das Verhältnis von Insulin zu Glukagon. In der postabsorptiben Phase ist die Insulin/Glukagon-Ratio geringer als in der absorptiven Phase. Die hormonellen Veränderungen regen die Zellen der Leber, gennant Hepatocyten, zum Abbau des Glykogens an. Glykogen ist wie, bereits erwähnt, die Speicherform von Glukose. Beim Abbau des Glykogens, der sogenannten Glykogenolyse, wird wieder Glukose freigesetzt.
Während sich der Glykogenspeicher langsam leert, führt das geringere Verhältnis von Insulin zu Glukagon auch zur Gluconeogenese, bei der Glukose aus Aminosäuren neu aufgebaut wird. Zudem werden die Fettspeicherzellen, genannt Adipocyten, zur Zerkleinerung und Freisetzung von Fett angeregt, der Lipolyse. Der absinkende Blutzuckerspiegel führt zur Freisetzung von Adrenalin, was zusätzlich die Lipolyse in den Adipocyten fördert.
Wenn die Glukosespeicher in der Leber und der Muskulatur geleert sind, werden Fettsäuren der Hauptenergielieferant für die Muskeln. Nur einige wenige Gewebe benötigen zu diesem Zeitpunkt dennoch Glukose, darunter das Gehirn und die roten Blutkörperchen. Die benötigte Glukosemege wird nun durch die Gluconeogenese gedeckt, also durch den Aufbau von Glukose aus Aminosäuren.
Anschließend an die postabsorptive Phase tritt etwa 24 Stunden nach der Mahlzeit die frühe Hungerphase ein. Wenn weiterhin keine Nahrung aufgenommen wird, begibt sich der Stoffwechsel etwa 5 Tage nach der letzten Nahrungsaufnahme in die adaptierte Hungerphase. In der frühen Hungerphase ist der Abbau körpereigener Proteinreserven zum Zweck der Gluconeogenese relativ hoch. Allein das Gehirn benötigt 110-130 g Glukose pro Tag. Ein andauernder Abbau des Körperproteins in dieser Geschwindigkeit würde rasch zum Tod des Fastenden führen. Deshalb sind proteinsparende Mechanismen für das Überleben während der Fastenperiode zwingend nötig.
Damit der Abbau körpereigener Proteinreserven minimiert werden kann, beziehen alle Organe, die nicht zwingend Glukose benötigen, ihre Energie mehr und mehr aus Fettsäuren. Das Gehirn benötigt in einer „nicht ketogenen“ Stoffwechsellage Glukose. Bei langanhaltendem Kohlenhydratmangel durch Fasten oder bewussten Verzicht, kann es aber einen Großteil seines Energiebedarfs statt durch Glukose durch Ketonkörper decken. Ketonkörper werden in der Leber aus Fettsäuren synthetisiert. Das Gehirn lernt in einer Anpassungsphase allmählich diese Ketonkörper zu verwerten. Dadurch sinkt der Glukosebedarf ab und weniger körpereigenes Protein muss zur Gluconeogenese abgebaut werden. Ketonkörper schützen Protein.
Mit fortschreitender Anpassung an das Fasten steigt die Ketonkörperkonzentration durch die Ketogenese in der Leber immer weiter an. So gelangen Ketonkörper in den Blutkreislauf und an die Organe wie Gehirn oder Muskulatur. Diese erkennen den neuen Treibstoff und lernen die Ketonkörper zu Energie zu verwerten – über den Vorgang, der sich Ketolyse nennt. Der Körper befindet sich in der adaptierten Hungerphase in einer ketogenen Stoffwechsellage und in Ketose. Bei Erwachsenen stellt sich Ketose nach einigen Tagen Fasten ein, bei Kindern innerhalb weniger Stunden.
Dies passiert also beim Fasten. Beim Verzicht auf Kohlenhydrate sieht der Vorgang im Stoffwechsel fast genauso aus. Die Adaption geht nur ein wenig langsamer, da noch Protein und Fett zur Verwertung zur Verfügung steht. Die „ketogene Diät“ heißt deshalb so, weil bei ihr Ketonkörper produziert werden. Aber wer ist eigentlich darauf gekommen, dass diese ketogene Ernährung ähnliche Effekte hat, wie das Fasten? Das kannst du im Artikel „Wer hat die ketogene Diät erfunden?“ nachlesen.
Dies ist der Beginn einer langen Reihe über Ketogene Ernährung. Ein bisschen Grundlagenwissen zum Start. Aber wofür – und für wen – ist eine kohlenhydratarme Ketogene Diät denn gut? Ist Low Carb und erst recht eine Ketogene Diät überhaupt dauerhaft durchführbar? Hat das Vorteile? Oder eher Nachteile? Wie verträgt sich Kohlenhydratreduktion mit Sport? Das sind alles Fragen, die in dieser langen Reihe über Ketogene Diät beantwortet werden. Die richtig spannenden Sachen kommen also erst noch! Dranbleiben lohnt sich!
Quellen:
Bonnefont JP, Specola NB, Vassault A, Lombes A, Ogier H, de Klerk, J B, Munnich A, Coude M, Paturneau-Jouas M, Saudubray JM. 1990. The FastingTest in Paediatrics Application to the Diagnosis of Pathological Hypo- and Hyperketotic States. Eur J Pediatr, 150(2): 80–85.
Cahill GF. 1976. Starvation in Man. Clin Endocrinol Metab, 5(2): 397–415.
Cahill GF. 2006. Fuel Metabolism in Starvation. Annu Rev Nutr, 26: 1–22.
Cahill GF, Herrera MG, Morgan AP, Soeldner JS, Steinke J, Levy PL, Reichard GA, Kipnis DM. 1966. Hormone-Fuel Interrelationships During Fasting. J Clin Invest, 45(11): 1751–1769.
Frayn KN. 2010. Metabolic Regulation. Dritte Aufl. Oxford: Wiley-Blackwell, 240-246.
Owen OE, Morgan AP, Kemp HG, Sullivan JM, Herrera MG, Cahill GF. 1967. Brain Metabolism during Fasting. J Clin Invest, 46(10): 1589–1595.
Owen OE, Felig P, Morgan AP, Wahren J, Cahill GF. 1969. Liver and Kidney Metabolism during Prolonged Starvation. J Clin Invest, 48(3): 574–583.
Stipanuk MH, Caudill MA. 2013. Biochemical Physiological and Molecular Aspects of Human Nutrition. Dritte Aufl. Philadelphia: Elsevier Saunders, 379-381.
Bild: Yevhen Vitte/shutterstock.com
Ketose und Ketonkörper. Diese beiden Begriffe werden in der Low Carb und Keto-Welt fröhlich durch die Gegend geworfen. Kann man irgendwie messen. Aber was steckt eigentlich dahinter? Was bedeuten diese Dinge im Stoffwechsel und auf chemischer Ebene?
Die offizielle Definition der Ketose lautet: „Ein Stoffwechselzustand, bei dem die Konzentration der Ketönkorper im Blut über den Normalwert erhöht ist“. Viel sagt das noch nicht aus. Was ist denn der Normalwert? Das ist der Wert, der ein Otto-Normal-Durchschnitts-Esser hat, wenn er nicht gerade für längere Zeit fastet oder auf Kohlenhydrate verzichtet. Unser Otto-Normal-Durchschnitts-Esser hatte wahrscheinlich gerade vor einer Stunde eine Käsesemmel und gerade eben ein Snickers. Er isst so 3-6 Mal am Tag und er fastet sogar täglich, nämlich dann, wenn er schläft.
So ein Otto-Normal-Durchschnitts-Esser hat eine Ketonkörperkonzentration im Blut von weniger als 0,1 mmol pro Liter. Das ist also der Normalwert und wenn man diesen Wert im Blut hat, dann ist man nicht in Ketose. Befindet sich ein Mensch in Ketose liegen die Werte meist zwischen 2-5 mmol/L. Dies ist absolut physiologisch, also ein gesunder Zustand. Mol und mmol sind übrigens eine Maßeinheit für Chemiker, ähnlich wie kg und g für den Koch.
Als Ketonkörper werden in der Medizin drei Verbindungen bezeichnet: Acetoacetat, β-Hydroxybutyrat und Aceton. Acetoacetat ist eine „Ketocarbonsäure“, β-Hydroxybutyrat eine „Carbonsäure“ und Aceton das einfachste „Keton“. Ketocarbonsäuren, Carbonsäuren und Ketone sind verschiedene Arten von kleinen organischen Molekülen. Kohlenstoffatome, Sauerstoffatome und Wasserstoffatome sind in den verschiedenen Molekülen auf unterschiedliche Weise verbunden. Wichtig ist: In diesen Verbindungen steckt Energie!
Ketone ist der Überbegriff für alle chemischen Verbindungen, die eine Doppelbindung von einem Kohlenstoffatom zu einem Sauerstoffatom haben, aber nur, wenn sie nicht am Rand des Moleküls ist. Heißt offiziell „eine nicht endständige Carbonylgruppe„. Von solchen Molekülen, solchen Ketonen, gibt es unfassbar viele Varianten. Ketonkörper gibt es aber nur drei und die haben ihren Namen daher, dass Acetoacetat und Aceton jeweils so eine „nicht endständige Carbonylgruppe“ in ihrer chemischen Struktur haben. Also: 2 Ketonkörper gehören zu den Ketonen, aber nicht alle Ketone sind Ketonkörper. (Raspberry-Ketone können noch so vielversprechend verkauft werden, sie haben absolut nichts mit Ketose zu tun.)
β-Hydroxybutyrat ist chemisch kein Keton, da die Ketogruppe zu einer Hydroxygruppe reduziert (umgewandelt) wurde. Trotzdem wird es mit zu den Ketonkörpern gezählt, denn es kann schnell aus Acetoacetat umgewandelt werden und hat vergleichbare Eigenschaften im Körper. Zudem kommt es unter den Ketonkörpern am häufigsten vor und ist der bedeutendste Ketonkörper im Stoffwechsel.
β-Hydroxybutyrat wird durch Enzyme aus Acetoacetat umgewandelt. Aceton hingegen entsteht durch spontanen Zerfall von Acetoacetat, ohne Enzyme. Es ist flüchtig und wird im Stoffwechsel so gut wie nicht weiterverwendet. Stattdessen wird es vor allem über die Lunge mit der Ausatemluft abgegeben. Dies ist für den süßlichen Mundgeruch verantwortlich.
Auch über den Urin werden Ketonkörper ausgeschieden. Dies nennt man Ketonurie – die Ausscheidung von Ketonkörpern mit dem Urin. Im Laufe der Zeit nimmt die Ausscheidung ab, da die Ketonkörper von den Organen besser verwertet werden und der Körper ja blöd wär‘, diese Energieträger einfach rauszuspülen.
Bei normaler, nicht-ketogener Stoffwechsellage im gesunden Menschen werden laufend geringe Mengen an Ketonkörpern von der Leber synthetisiert und von anderen Organen verbraucht. Die Konzentration von Acetoaceton und β-Hydroxybutyrat beträgt nach einer Mahlzeit etwa 0,01 mmol pro Liter Blut. Selbst nach nächtlichem Fasten ist ihre Konzentration im Blut mit 0,1 mmol/L noch relativ gering. Erst bei andauerndem Nahrungsverzicht steigt sie allmählich und erreicht nach etwa dreitägigem Fasten 2 mmol/L und nach einer Woche ohne Nahrungsaufnahme etwa 5 mmol/L. In diesem Bereich spricht man von Ketose.
Der Blutzuckerspiegel befindet sich während der Ketose am unteren Rand der physiologischen Konzentration, aufrechterhalten durch Gluconeogenese aus Aminosäuren und Glycerin. Gluconeogenese ist der Aufbau von Glucose aus Molekülen, die keine Kohlenhydrate sind, wie Aminosäuren aus Proteinen oder aus Glycerin einem Teil der Triglyceride, der Fette.
Ketose, ein physiologischer (normaler und gesunder) Zustand bei Nahrungsverzicht, darf nicht mit Ketoazidose verwechselt werden, einem pathologischen (krankhaften) Zustand, der bei Diabetes und Alkoholmissbrauch auftreten und lebensbedrohlich werden kann. Bei unkontrolliertem Diabetes Typ I kann die Ketonkörperkonzentration bis auf 25 mmol/L steigen, dann entsteht eine gefährliche Ketoazidose. Dabei werden die Puffermechanismen des Blutes überlastet, die sich normalerweise um das Säure-Basen-Gleichgewicht kümmern, und das Blut übersäuert. Wenn ein gesunder Mensch fastet oder sich sehr kohlenhydratarm ernährt, werden solche schädlichen Werte aber nicht erreicht.
Es war der Biochemiker Hans Krebs (Entdecker des Krebs-Zyklus aka Citrat-Zyklus), der als erstes von „physiologischer Ketose“ als Unterscheidung zur diabetischen Ketoazidose sprach. In physiologischem Rahmen erhöhte Ketonkörperkonzentrationen treten wie gesagt nicht nur beim Fasten auf, sondern auch bei kohlenhydratlimitierten, sogenannten „ketogenen Diäten“.
Der Stoffwechselzustand der Ketose ist sehr fragil und kann durch die Gabe von Insulin oder Glukose rasch unterbunden werden. Besonders in der Anfangszeit, wenn sich die Leber und die anderen Organe gerade erst umstellen und lernen Ketonkörper zu produzieren und zu verwenden. Kohlenhydrataufnahme führt zu einer Insulinausschüttung. Insulin hemmt die Ketonkörperproduktion und führt dazu, dass Ketonkörper mit dem Urin ausgeschieden werden. Auch eine hohe Menge an Protein führt zu einer Insulinausschüttung, hat aber keine ganz so starke Wirkung auf die Ketose. Denn bei der Proteinaufnahme wird zeitgleich Glukagon ausgeschüttet, der Gegenspieler des Insulins.
Die kleinen Ketonkörper sind energiereiche Verbindungen. In Fett steckt auch viel Energie. Aber was passiert, wenn man Wasser und Fett miteinander mischen will? Klappt nicht so ganz. Da unser Blut zum Großteil aus Wasser besteht ist es auch eher eine schlechte Idee, darin Fett auflösen zu wollen um Energie von A nach B zu transportieren. Deswegen wandelt die Leber das Fett erst in kleine Ketonkörper um. Die Betonung liegt hier auf klein, denn das ist unter anderem ein Grund, wieso Ketonkörper gut wasserlöslich sind. Im Gegensatz zu Fett können sie leicht mit dem Blut transportiert werden. In der Evolution des Menschen ermöglichte die Fähigkeit zur Ketogenese (Erzeugung von Ketonkörpern) und Ketolyse (Verwertung von Ketonkörpern) das Überleben in langen Hungerphasen, da dem immer größer werdenden Gehirn der menschlichen Vorfahren aus den Fettreserven eine Energiequelle zur Verfügung gestellt werden konnte.
Quellen:
Cahill GF, Veech RL. 2003. Ketoacids Good Medicine. Trans Am Clin Climatol Assoc, 114: 149-161.
Fronzo R de, Ferrannini E. 2001. Regulation of Intermediary Metabolism During Fasting and feeding. In: DeGroot LJ, Jameson JL. Endocrinology. Sechste Aufl. Philadelphia: W.B. Saunders, 735–755.
Fukao T, Lopaschuk GD, Mitchell GA. 2004. Pathways and Control of Ketone Body Metabolism on the Fringe of Lipid Biochemistry. Prostaglandins Leukot Essent Fatty Acids, 70(3): 243–251.
Krebs HA. 1966. The Regulation of the Release of Ketone Bodies by the Liver. Adv Enzyme Reg, 4: 339–354.
Page MM, Alberti KG, Greenwood R, Gumaa KA, Hockaday TD, Lowy C, Nabarro JD, Pyke DA, Sönksen PH, Watkins PJ, West TE. 1974. Treatment of Diabetic Coma with Continuous Low-Dose Infusion of Insulin. Br Med J, 2(5921): 687–690.
Rehner G, Daniel H. 2010. Biochemie der Ernährung. Dritte Aufl. Heidelberg: Spektrum Akademischer Verlag, 471-475.
Stipanuk MH, Caudill MA. 2013. Biochemical Physiological and Molecular Aspects of Human Nutrition. Dritte Aufl. Philadelphia: Elsevier Saunders, 379-381.